? ? ? ?來源:閑談 Immunology
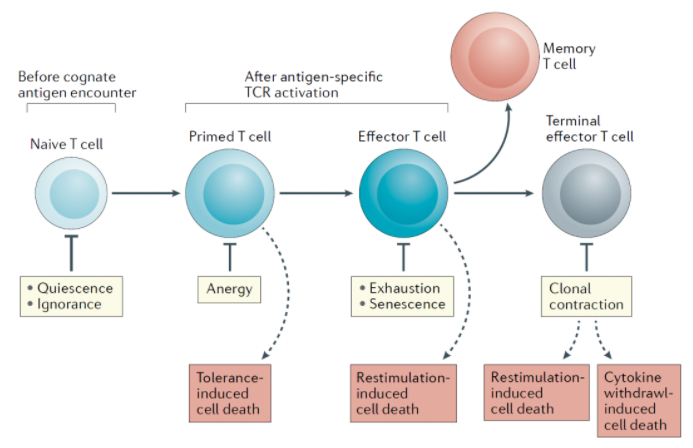
T細(xì)胞不同階段的耐受機(jī)制(文獻(xiàn)1) ? ? ? ?1. 靜息(Quiescence) ? ? ? ?靜息是限制naive T細(xì)胞對滋養(yǎng)型(tonic)信號(自身抗原等)產(chǎn)生反應(yīng),此時(shí)細(xì)胞處于G0期,維持小細(xì)胞形態(tài),處于基礎(chǔ)代謝狀態(tài),不會向效應(yīng)表型分化。 意義: ? ? ? ?? 防止Naive T細(xì)胞擴(kuò)增,使之維持在一定數(shù)量范圍之內(nèi)。 ? ? ? ?? 克隆選擇:確保大部分結(jié)合特定抗原的T細(xì)胞repertoire受到限制,限制高親和力的克隆擴(kuò)增。 ? ? ? ?? 靜息的閾值是固定的還是一個(gè)動態(tài)范圍,仍然不是很清楚。但是對閾值的精準(zhǔn)調(diào)節(jié),有助于發(fā)揮適度的抗感染或者抗腫瘤免疫反應(yīng),但是不引起自身免疫性疾病。 ? ? ? ?? TGF-β和TOB1是重要的靜息調(diào)控因子,他們通過SMAD通路下調(diào)IL-2的產(chǎn)生及抑制T細(xì)胞活化。TOB1是APRO基因家族的成員,編碼抗增殖的蛋白質(zhì)(包括BTG1和BTG2)。 ? ? ? ?? 轉(zhuǎn)錄因子RUNX1調(diào)控KLF2,F(xiàn)OXO1,F(xiàn)OXP1,他們都是靜息T細(xì)胞的關(guān)鍵轉(zhuǎn)錄因子。 ? ? ? ?? TSC1 和 TSC2通過抑制mTORC1活性,下調(diào)靜息T細(xì)胞的代謝。 ? ? ? ?2. 忽視(Ignorance) ? ? ? ?忽視是Naive T細(xì)胞階段的另外一種外周耐受的模式。 ? ? ? ?盡管特定的自我抗原存在,自反應(yīng)T細(xì)胞不能激活和引起自身免疫性疾病,這些T細(xì)胞仍處于Naive的狀態(tài)。 ? ? ? ?內(nèi)在機(jī)制:抗原和TCR親和力過低,不能引起T細(xì)胞反應(yīng)。 ? ? ? ?外在的機(jī)制:包括抗原密度低或者解剖位置限制了抗原識別的發(fā)生,導(dǎo)致T細(xì)胞無法激活。 ? ? ? ?忽視不是T細(xì)胞功能不全,在特定刺激(如病毒感染,促炎癥因子等)情況下,T細(xì)胞會克服忽視狀態(tài),成為效應(yīng)細(xì)胞。 ? ? ? ?靜息和忽視的區(qū)別: ? ? ? ?靜息是所有Naive T細(xì)胞的通用標(biāo)志,與抗原特異性無關(guān)。 ? ? ? ?忽視是避免激活自身反應(yīng)性T細(xì)胞,可能是進(jìn)化上依舊不完美的中樞耐受的補(bǔ)充。 ? ? ? ?3. 無能(Anergy) ? ? ? ?Naive T細(xì)胞的TCR結(jié)合抗原,但是低反應(yīng)或者無反應(yīng)。它作為T細(xì)胞啟動過程中的早期檢查點(diǎn),以防止在T細(xì)胞進(jìn)入效應(yīng)階段前出現(xiàn)潛在的T細(xì)胞致病性。 ? ? ? ?分子機(jī)制是缺乏共刺激分子,不能激活NFAT1和AP1,不引起細(xì)胞分化和效應(yīng)功能,反而通過RAS-MAPK通路抑制AP1入核。無能的特征是IL-2,IFN-γ,TNF-α等因子減少,mTORC1活性被抑制,代謝被抑制。此外,無能細(xì)胞高表達(dá)CD73,F(xiàn)R4,LAG3等抑制性受體,但是不同于Treg,它不表達(dá)FoXP3. ? ? ? ?和靜息細(xì)胞不同,無能細(xì)胞的細(xì)胞周期停滯在G1進(jìn)入S期,而靜息細(xì)胞停滯在G0期。 ? ? ? ?無能是一個(gè)長時(shí)間的狀態(tài),但是可以被反復(fù)抗原暴露,以及加入IL-2等細(xì)胞因子狀態(tài)下被逆轉(zhuǎn)。 ? ? ? ?4. 耗竭(Exhaustion) ? ? ? ?耗竭主要因素是慢性感染或者腫瘤,產(chǎn)生的持續(xù)抗原暴露,引起的T細(xì)胞功能損壞。與無能的區(qū)別是,耗竭T細(xì)胞不缺少共刺激分子,但是大量抑制性免疫檢查點(diǎn)表達(dá)。 ? ? ? ?5. 衰老(Senescence) ? ? ? ?衰老是生長和增殖停滯狀態(tài)。與耗竭的慢性持續(xù)抗原暴露不同,衰老是TCR接受反復(fù)刺激或者淋巴細(xì)胞老化,引起端粒損傷或者DNA損傷,在遭遇抗原刺激時(shí),T細(xì)胞復(fù)制能力丟失,多發(fā)生在效應(yīng)或記憶分化階段。從進(jìn)化的角度講,衰老可以避免DNA損傷的T細(xì)胞過度增殖,避免形成淋巴瘤。 ? ? ? ?一些引起端粒損傷的因素(活性氧ROS,電離輻射,生長因子剝奪),影響端粒酶活性,也可以加速淋巴細(xì)胞衰老。 ? ? ? ?缺乏增殖能力的衰老細(xì)胞表達(dá)CD45RA,KLRG1和CD57,不表達(dá)CD27,CD28等共刺激因子。和耗竭細(xì)胞不同的是,衰老細(xì)胞雖不能增殖,但是效應(yīng)功能并不受影響,可以分泌促炎癥因子和炎癥抑制因子(衰老分泌表型)。 ? ? ? ?和經(jīng)典的p38激活不同,此時(shí)p38激活時(shí)通過細(xì)胞內(nèi)感受器AMPK,通過TAB1激活p38,產(chǎn)生后續(xù)功能。 ? ? ? ?衰老引起對的增殖能力丟失,會引起對疫苗接種的低應(yīng)答,這也是老年人疫苗接種應(yīng)答率低的一個(gè)因素。 ? ? ? ?6.外周清除耐受(Peripheral deletional tolerance (death)) ? ? ? ?在免疫反應(yīng)結(jié)束的階段(收縮期),通過凋亡清除過多的免疫細(xì)胞。 ? ? ? ?機(jī)制: ? ? ? ?Bcl-2家族線粒體凋亡途徑:促凋亡的BIM和抗凋亡Bcl-2家族分子維持著凋亡平衡,外周清除耐受時(shí)促凋亡作用為主。 ? ? ? ?AICD:活化誘導(dǎo)的細(xì)胞死亡(activation- induced cell death,AICD)是清除發(fā)揮完功能的效應(yīng)T細(xì)胞的主要機(jī)制。FasL-Fas及TRAIL-TRAILR1 TRAILR2凋亡通路為主。 外周耐受的主要調(diào)控因子 ? ? ??如涉及知識產(chǎn)權(quán)請與我司聯(lián)系
主要參考文獻(xiàn) Mohamed A. ElTanbouly and Randolph J. Noelle,Rethinking peripheral T cell tolerance: checkpoints across a T cells journey,Nat Rev Immunol . 2020 Oct 19. Akbar, A. N., Henson, S. M. & Lanna, A. Senescence of T lymphocytes: implications for enhancing human immunity. Trends Immunol. 37, 866–876 (2016). |