▉?導讀 上期推送中我們為大家介紹了nTregs在維護自身耐受中的重要作用。進入血液和淋巴液中的大量組織抗原,不會引發T細胞反應,主要是由于nTregs的作用。本期推送中我們繼續探索自身耐受的世界,看看“調皮”的T細胞還會進入哪里,為機體帶來怎樣的風險? 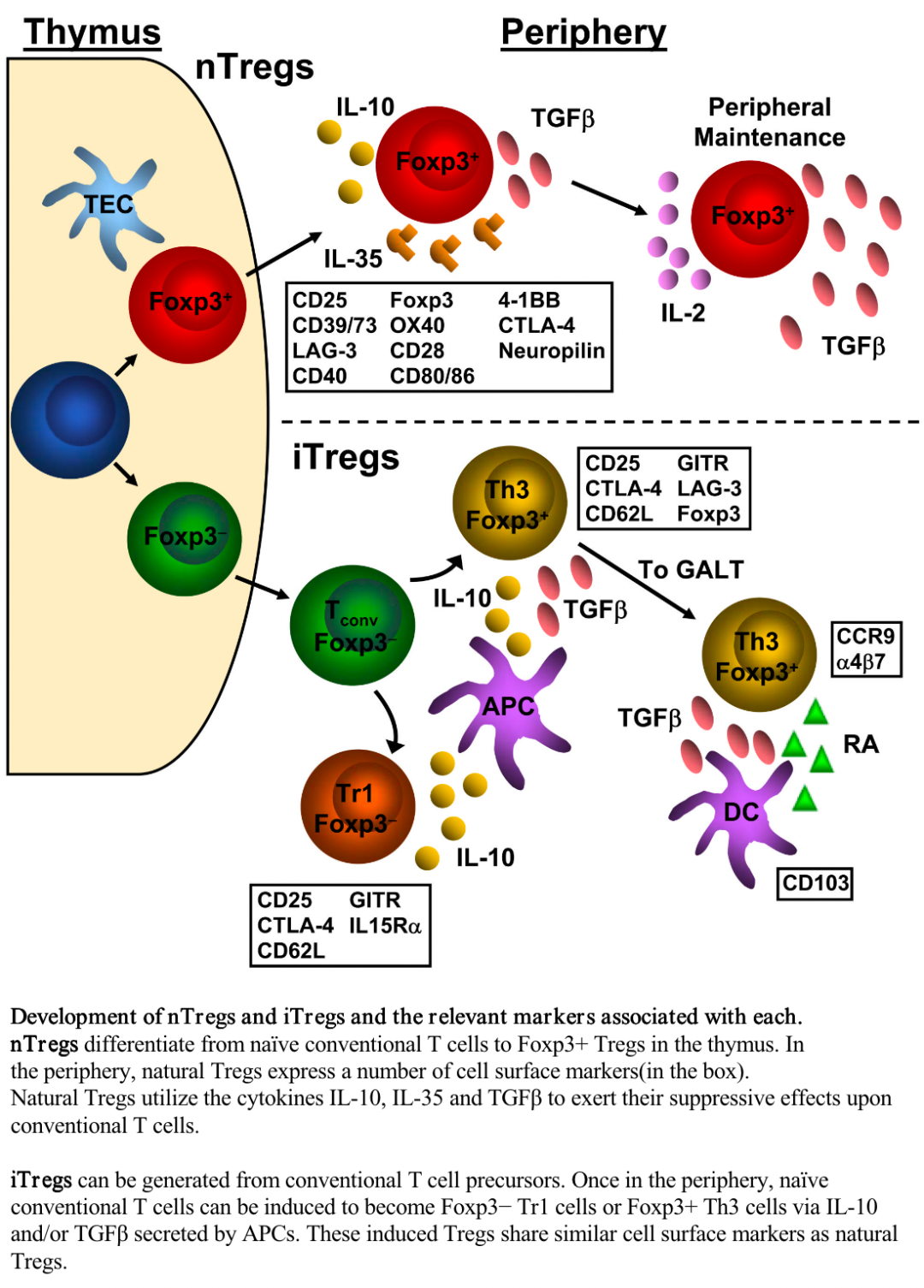
nTreg和iTreg細胞的產生及表面marker《The Development and Function of Regulatory T Cells》▉?外周免疫耐受 初始T細胞是不完美的,有時候它真的會從通道中“溜走”,進入組織。每個正常人組織中也的確存在這樣可潛在發生自身反應的T細胞。這種通道規則的打破,會使T細胞遇到陰選過程中缺失的抗原,也就是在胸腺稀有存在,在外周組織大量存在自身抗原。由于未經過陰性選擇篩選,T細胞可以與這種抗原反應,那么,我們該怎么辦?對T細胞大戰坐以待斃? 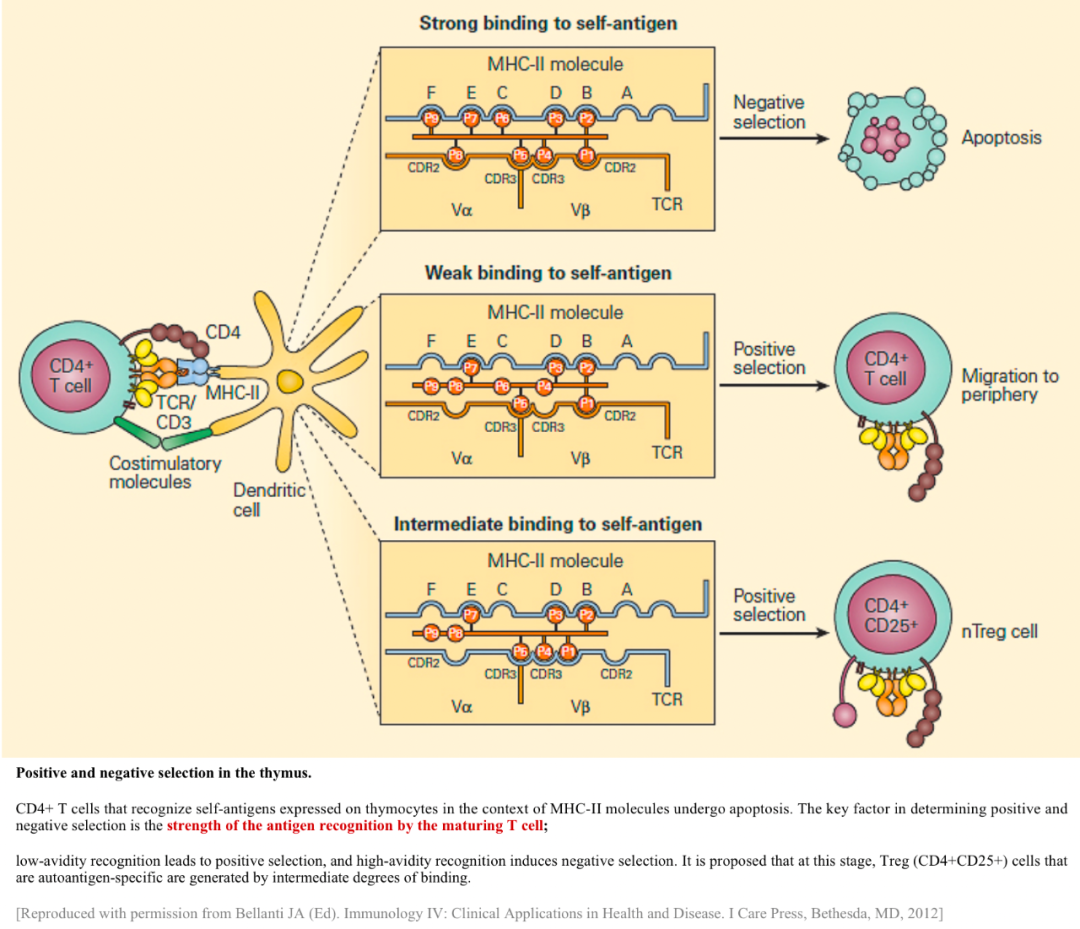
T細胞的陽選和陰選(是由T細胞與MHC-自身抗原復合物的結合強弱程度決定的)機理及結果 https://www.immunopaedia.org.za/immunology/advanced/2-central-peripheral-tolerance/ 別急,機體早已準備了秘密武器,正好派上用場。這個秘密武器就是:外周免疫耐受(peripheral tolerance)!
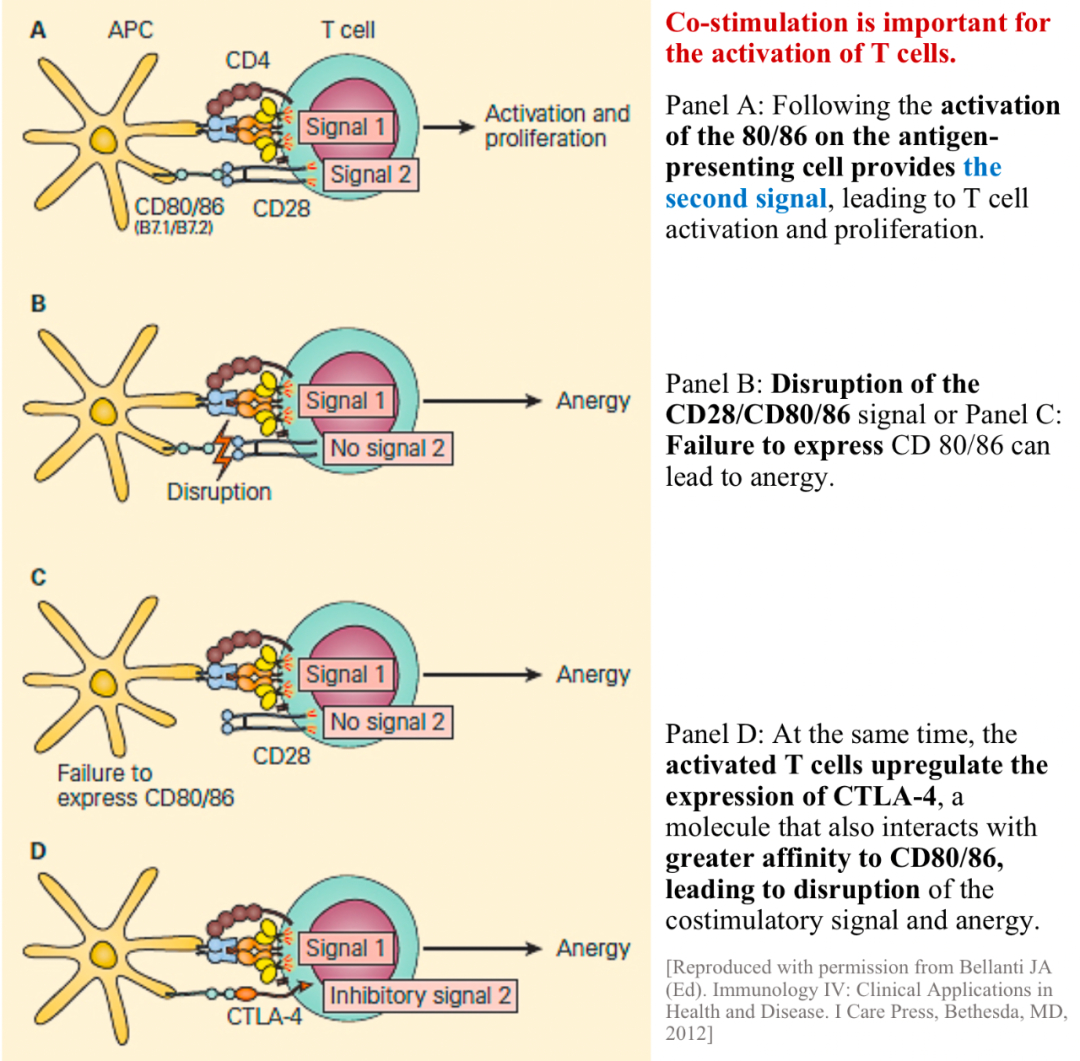
共刺激信號對于T細胞活化必不可少 https://www.immunopaedia.org.za/immunology/advanced/2-central-peripheral-tolerance/
眾所周知,T細胞活化需要2個要素:足夠的抗原和共刺激信號。初始T細胞需要足夠的抗原才能簇集受體,而共刺激信號則來源于抗原提呈細胞(APC重要作用之一:提供共刺激信號)。抗原提呈細胞表面含有大量MHC分子用于抗原提呈,同時表達如B7樣的共刺激分子。相反,如心臟、腎臟等普通組織細胞不會表達高水平MHC分子和/或共刺激分子。因此,初始T細胞盡管具有可識別腎臟抗原的受體,卻無法被腎臟細胞活化。實際上,機體安保工作做得更加到位!
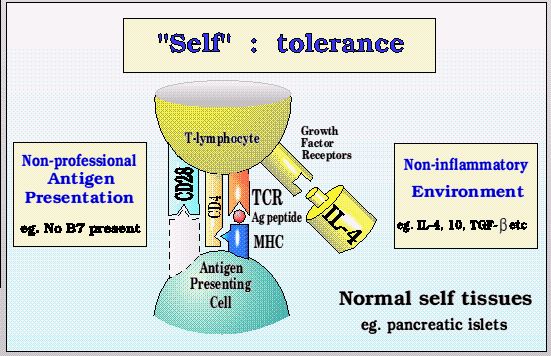
正常外周組織(如胰島)自身抗原耐受機制http://users.path.ox.ac.uk/~scobbold/tig/tolg2.html 當初始T細胞識別提呈抗原,卻接受不到共刺激信號時,該T細胞呈“無能”狀態。此時,它雖然看起來像T細胞,但早已失去了T細胞的功能。大多數情況下,這種無能細胞會走向死亡。因此,外周免疫耐受的結局就是T細胞的無能或死亡。因此,T細胞活化過程中需要第二信號的機制為避免進入外周組織的初始T細胞活化提供了保障。 ▉?AICD 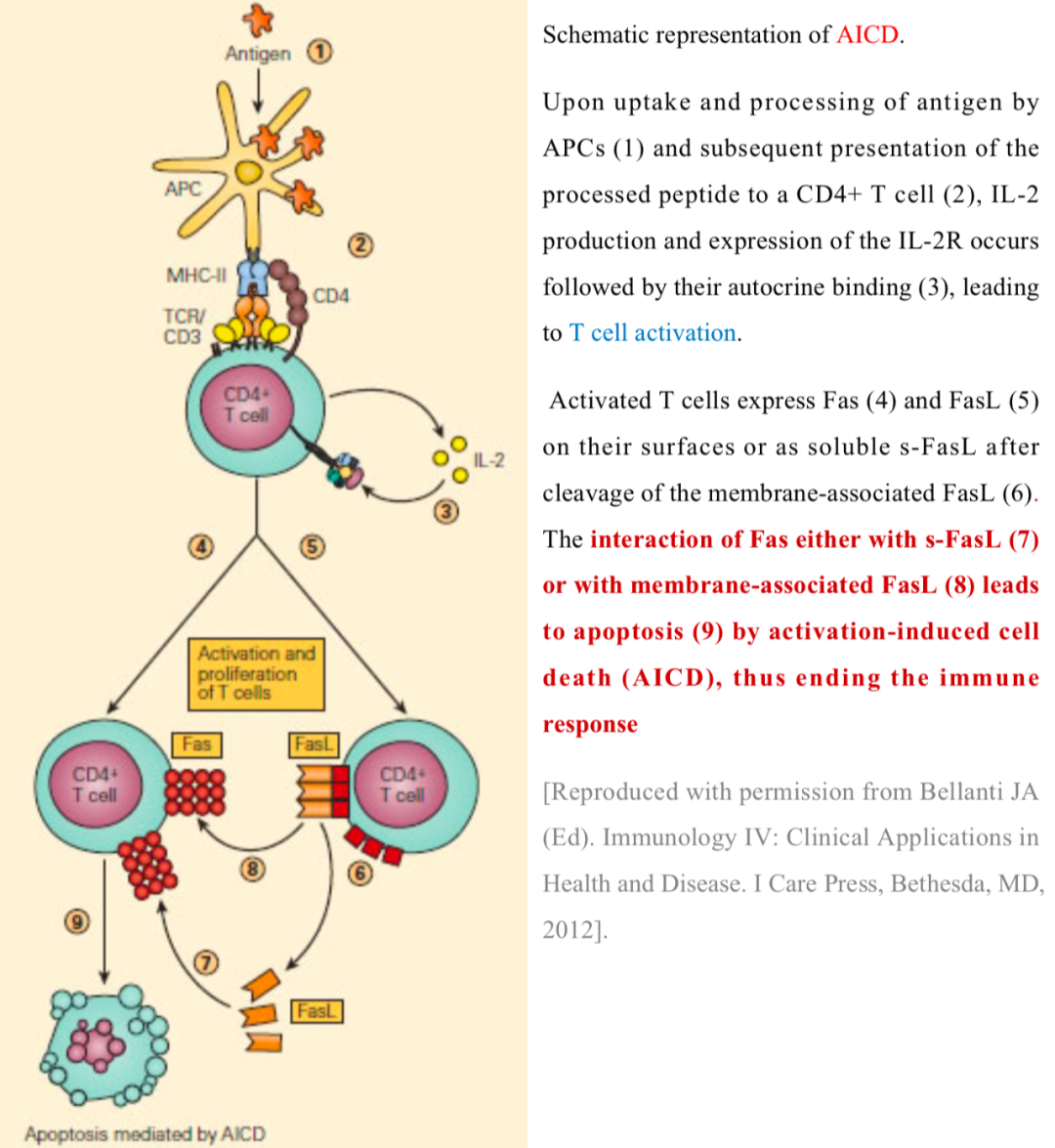
活化的T細胞表達Fas/FasL誘導自身凋亡 https://www.immunopaedia.org.za/immunology/advanced/2-central-peripheral-tolerance/ 問題又來了。如果T細胞躲過了胸腺清除,打破了通道規則,逃逸到外周組織,假定其恰好碰到被MHC提呈的對應抗原,又剛好存在共刺激分子,那該怎么辦??別急,還有希望!在這個緊要關頭,我們還有秘密武器。
AICD(activation-induced cell death)活化誘導的細胞死亡,即活化T細胞通過Fas/FalL退下戰場。當活化T細胞周圍不存在“入侵者”時,T細胞會通過AICD結束使命。這種機制也可以幫助我們擺脫非正常情況下初始T細胞活化帶來的麻煩。 ▉?總結—T細胞自身免疫耐受“五層設防” 學習到此,我們可以看出,T細胞耐受誘導是多層次的。它不是對單個T細胞一一進行檢查,而是采用這種“層層設障”的模式為機體提供保護。這種保護的結果就是,我們大多數人不會產生自身免疫病。 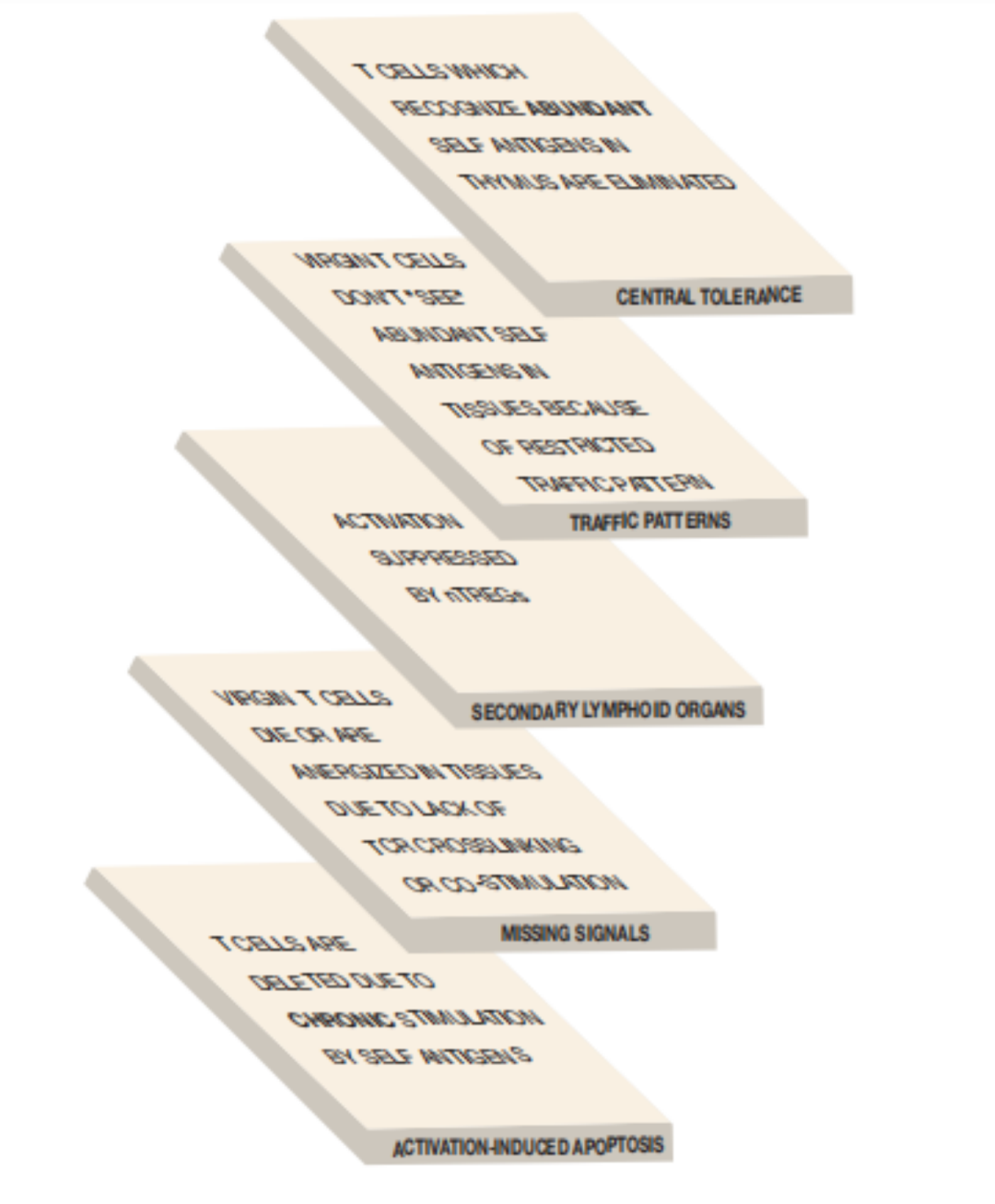 自身免疫耐受的五層保障 自身免疫耐受的五層保障
本期推送中,我們為大家介紹了T細胞進入外周組織因缺乏抗原提呈或/和共刺激分子而造成的外周免疫耐受,并指明外周免疫耐受的結局為T細胞的無能或死亡。進一步分析如果外周組織中存在一切可激活T細胞的條件時,T細胞是否可誘導自身免疫。正常情況下,人體不會出現自身免疫病,因為機體提供了5層保障確保自身免疫耐受。因此,文章的結尾我們指出T細胞免疫耐受的終極法寶就是AICD。 ▉?下期預告 不知道,通過本期的講解,小伙伴是否對T細胞自身免疫耐受形成了清晰的認識。下期推送中,我們將奉上B細胞免疫耐受的機制,敬請期待。 如涉及知識產權請與我司聯系
|