? ? ?? 來源:生物制品圈
? ? ?? 抗體藥物包括單克隆抗體藥物,抗腫瘤單抗偶聯物,雙特異性抗體,抗體片段等等。這些藥物的靶點主要是細胞表面與疾病相關的抗原或特定的受體分子。抗體進入人體之后,首先與相應抗原發生特異性結合,再通過一系列的生物學作用,如偶聯放射性核素的殺傷作用、阻斷細胞因子的信號轉導、引起補體的級聯激活等,進而發揮抗體的治療作用。
? ? ?? 在抗體藥物的臨床前研發中,一旦確定抗體藥物的分子形式并在哺乳動物細胞中表達出抗體蛋白分子后,就需要對抗體的活性進行驗證與測定。活性測定是對藥物的有效成分和含量以及藥物效價的測定,是確保抗體類藥物有效性的重要質控指標。目前研發生產中主要通過測定抗體的抗原結合能力來評價活性,常用的方法有ELISA法;流式細胞儀法;一些新技術測定法如SPR技術,目前應用較為廣泛的是GE醫療生命科學的Biacore。另外還可以模擬抗體的作用機制,測定其體外生物學活性并進行評價。
一、抗原結合能力測定
1. ELISA法
? ? ?? 用ELISA法測定抗體的抗原結合能力一般需要具備相應的可溶性抗原。將可溶性抗原包被于96孔板中,待測抗體與標準品作系列稀釋,并分別與酶標抗體混合后加入96孔板,待測抗體與標準品將與酶標抗體競爭結合包被抗原,孵育一段時間后洗脫未結合的抗體,隨著待測抗體濃度的降低,酶標抗體與包被抗原的結合量逐漸增加,檢測的吸收值逐漸增高,并與待測抗體的濃度呈負相關性。對待測抗體濃度、吸光值作四參數擬合,可得到反“S”形曲線,以曲線的IC50 值評價抗體的抗原結合能力。ELISA方法操作比較簡單、耐用性好,為避免標記抗體活性或其他試驗因素對測定結果的影響,必須有標準品進行平行操作。
2. 流式細胞儀法
? ? ?? 流式細胞儀測定與ELISA法測定原理基本相同,不同的是將可溶性抗原變為細胞,并通過流式細胞儀測定細胞的陽性率指標來檢測待測抗體與標記抗體的競爭結合情況。該方法的優點是選用攜帶抗原的細胞進行檢測,細胞表面的抗原空間結構更接近體內存在形式,使待測結果更接近實際情況,另外該方法還避免了相應抗原的制備純化過程,對于不易獲得可溶性抗原的抗體可采用該方法進行測定(圖1)。
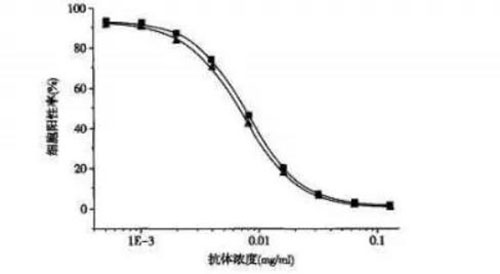
圖1 流式細胞儀測定抗體的抗原結合能力
3. 新技術測定法
? ? ?? 基于新技術的生物學活性測定方法主要有表面等離子共振效價測定法(SPR)、均相時間分辨熒光、 Alpha 技術、熒光染料標記法等,這里我們主要介紹一下SPR法在蛋白活性測定過程中的應用。
? ? ?? 表面等離子共振技術(Surface Plasmon Resonance,SPR)是一種用于生物分子間相互作用分析的新技術,已經成為抗體領域分子互作的“金標準”并被FDA收錄。
? ? ?? 目前在基礎科研和制藥行業被廣泛應用的儀器是GE醫療生命科學的Biacore。它可以應用于抗體候選物的篩選與評價;抗體與抗原結合活性的分析;抗體與受體結合活性的分析;抗體活性濃度分析;安全性評價中的免疫原性分析;生物類似藥一致性分析以及抗體生產質控與批次放行等。
? ? ?? SPR具體測定過程如下:將抗體固定于芯片表面,待測抗原通過微流控系統流經其上,抗原抗體一旦結合,芯片表面的物質質量濃度就會增加,進而引起芯片表面液體折射率的變化而被檢測到。該技術測定抗原抗體結合活性時不需要標記,避免了標記對分子結構的影響,能更加真實地反映抗原抗體的結合情況。它測定周期短,樣品用量少,一般僅有微克級,可用于微量樣品的測定。同時使用親和力信息及動力學信息來闡述分子間結合機理(圖2)。

圖2? SPR技術作用原理
1) 抗體與抗原結合活性的分析,抗體候選物的篩選與評價
? ? ?? GE醫療生命科學的Easy Biacore是基于SPR技術,利用捕獲法檢測抗原抗體之間的相互作用。它主要利用捕獲分子與配體之間高親和的特性,從而實現對配體定向捕獲(圖3)。該方法操作簡便,檢測速度快;雜交瘤細胞上清等粗樣品可直接上樣,無需純化;芯片可再生后反復使用、運行成本低。羅氏診斷對診斷抗體的篩選也是利用了Biacore的“捕獲法”:兔子腹水直接上樣,一次性完成130個單抗的篩選,并結合Biacore強大的功能做Ranking得到了最好的Top5目的抗體。


圖3 Biacore捕獲法檢測抗原抗體之間相互作用
2) 抗體與受體結合活性的分析,如抗體與FcγRllla、FcγRlllb 等受體結合的親和力、動力學信息
? ? ?? 2019 年 2 月, 首個國產生物類似藥漢利康正式獲批上市, 開啟了中國生物類似藥新時代。在生物類似藥的分析相似性評價中,關鍵一環就是說明藥物的結合活性與原研藥相似度,從而確定me too or me better。復宏漢霖漢利康?(HLX01)的抗體免疫特性的檢測,是基于GE生命科學的 Biacore 完成的。
? ? ?? 在抗體-FcγR 受體結合活性分析中,使用 Biacore T200 分別檢測了不同抗體與FcγRIa,FcγRIIa,FcγRIIb/c,FcγRIIIa-F,FcγRIIIa-V ,FcγRIIIb 和 FcRn 的結合。Fc 受體結合分析測試的結果顯示,HLX01 與 CN-Rituximab 和 EU-Rituxima 結果高度相似(圖4)。

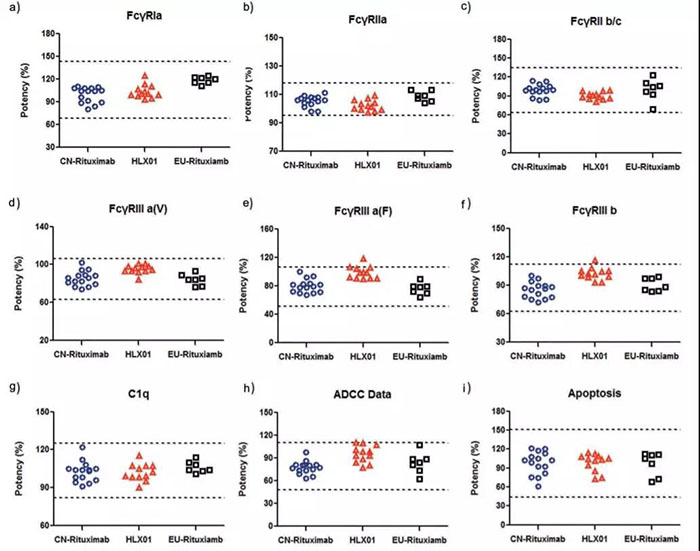
圖4 HLX01 與 CN-Rituximab 和 EU-Rituxima 相似性結果
3) 抗體活性濃度分析, 包括基于標準品的活性成分濃度分析和無需依賴標準品的活性成分濃度分析方法
? ? ?? 目前,GE醫療生命科學的Biacore基于SPR的無標曲檢測法(CFCA calibration-free concentration analysis)可用于蛋白樣品的有效活性濃度檢測,這種方法直接檢測有效互作的分子,無需進行復雜的樣品處理和方法建立。結果可靠,簡單和精準,或可成為活性蛋白濃度檢測基準方法。
? ? ?? Biacore檢測是將配體固定在芯片表面,分析物流經芯片表面。在這個過程中,分析物的濃度受到物質遷移速率的影響。CFCA檢測可通過分析物以兩種流速流經芯片表面,通過物質遷移速率的計算,儀器自動擬合出分析物的濃度(圖5)。
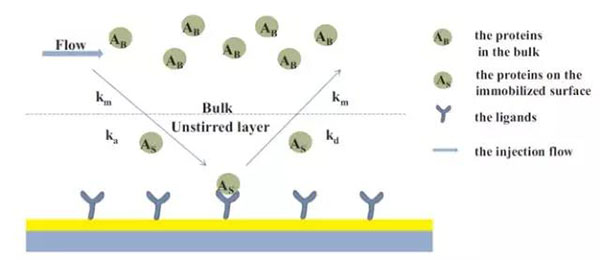
圖5 分析物在流路管路中由溶液向芯片表面垂直擴散
二、生物學活性測定
1. 補體依賴細胞毒(complement-dependent cytotoxicity,CDC)作用
? ? ?? 有些抗腫瘤抗體的作用途徑之一是通過補體依賴的細胞毒作用。CDC作用機制如下:抗體先與細胞表面抗原結合形成抗原-抗體復合物,抗體Fc 片段的補體結合位點暴露并與補體C1結合,進而通過后續的補體級聯激活途徑完成攻膜復合物的裝,在細胞表面打孔,最終導致溶細胞效應。
? ? ?? 體外測定抗體CDC 作用的過程基本是模擬其體內作用方式。選擇具有相應抗原的細胞鋪板,加入不同稀釋度的抗體孵育,使抗體與細胞表面抗原充分結合,然后再加入補體孵育,結合于細胞表面的抗體將補體成分激活,進而將細胞殺死。由于抗體濃度不同,細胞的殺傷率也不同,對體濃度及吸光度進行四參數曲線擬合可得到反S 形曲線,以其EC 值作為評價抗體CDC 活性的指標。
2. 殺傷活性中和試驗
? ? ?? 有些細胞因子與其受體結合后能產生細胞殺傷活性,針對該細胞因子的抗體能阻斷其與受體的結合,對其殺傷活性其有中和效應。例如,腫瘤壞死因子-α(TNF-α)能與胞表面受體結合并對細胞產生毒性作用。因此人們研制出針對TNF-α的抗體用于類風濕關節炎的治療。該抗體即可通過殺傷活性中和試驗來評價。選擇一種對殺傷作用敏感的細胞株, 培養至合適密度后加入96 孔板;用一定濃度TNF-α 溶液將待測抗體及標準品作梯度稀釋,然后將各稀釋度的抗體溶液加入含有細胞的孔板中孵育, 抗體與TNF-α結合后斷了其與細胞表面受體的結合· 中和了其細殺傷活性,因此抗體濃度越高,中和作用越強,細胞的生存率也越高;對活細染色后定OD值,對抗體濃度進行四參數擬合,以EC50值作為評價抗體活性的指標。
3. 細胞增殖抑制試驗
? ? ?? 增殖抑制試驗的原理與殺傷抑制試驗相似,同樣是通過阻斷細胞因子對細胞的作用來反映抗體的活性。該方法中細胞的生長對細胞因子具有依賴作用,當細胞因子與待測抗體結合后, 無法與細胞表面受體結合,細胞在得不到增殖刺激的情況下死亡。抗體濃度越高,增殖抑制作用越強,細胞死亡率越高,繼而擬合得到相應的四參數曲線。
4. 熒光素酶報告基因法測定中和活性
? ? ?? 由于有些細胞因子與細胞表面受體結合后的信號傳導通路已經比較了解,可以在細胞中插入熒光素酶報告基因,如果細胞因子與其受體結合,將引起熒光素酶的表達,通過加入底物顯色可以對結合情況進行評價。針對這些細胞因子的單抗可通過熒光素酶報告基因法定中和活性,如針對IL-1β 的卡那奴單抗(canakinumab),測定原理如下:將帶有熒光素酶報告基因的鋪板,加入梯度稀釋的待測單抗及參比品,再加入IL-1β,IL-1β能刺激細胞引起熒光素酶的表達,但抗體與IL-1β 結合能中和其作用。隨著抗體濃度的增加, 熒光素酶表達量減少, 兩者呈負相關性, 最后加入底物顯色并檢測,通過平行線分析法計算待測單抗的活性。
? ? ?? 分子生物學的快速發展和細胞信號通路的深入研究促進了基于細胞的生物活性測定方法的發展。越來越多的新型技術用于單抗藥物的活性檢測,可以實現對抗體藥物進行精準、多方位、動態的分析,為抗體藥物的質量提供了新的保障。
? ? ?? 如涉及知識產權請與我司聯系
參考文獻:
[1]王蘭,徐剛領,高凱,王軍志. 抗體類生物治療藥物活性測定方法[J].中國生物工程雜志,2015(6):101-108
[2] Patrick E,Anne V H,Michel V,et a1.Surface plasmon resonance:principles, methods and applications in biomedical sciences.Spectroscopy,2003,17(2):255-273.
[3] Guo x.Surface plasmon resonance based biosensor technique:a review.J Biophotonics,2012,5(7):483-501.
|